
与传统的2D 细胞培养技术相比,3D 细胞球体提供了更多的仿生微环境, 在许多组织工程应用中已被证明是有价值的。尽管3D 细胞培养具有受益 效应,但目前球体形成方法的可扩展性有限,对球体组织工程的临床翻译 提出了挑战。虽然最近采用的液滴微流体可以提供一个连续的生产过程, 但使用油和表面活性剂,通常低通量,以及额外的生物制造步骤的要求阻 碍了球体培养的临床翻译。在这里,使用清洁(例如,无油和无表面活性 剂) ,超高通量(例如,8.5 mL min-1,10000个球体 s-1) ,单步空气微流控 生物制造球体形成区室化水凝胶。这种新技术可以可靠地生产一维纤维, 二维平面和三维体积划分的水凝胶构造,其中每一个都允许空心球形成隔 室的明显(一)各向同性取向。在喷墨生物打印分区水凝胶中产生的球体在 成软骨行为方面优于2D 细胞培养物。此外,细胞球体可以从划分的水凝 胶中获得,并用于以自下而上的方式构建形状稳定的厘米大小的无生物材 料的活组织。因此,预计在空气中微流体生产的球形分区水凝胶可以促进 生产和使用的细胞球体的各种生物医学应用。
2D 体外细胞培养历来是组织工程领域的 黄金标准,其目的是修复、再生或替换受 损的活组织。然而,传统的2D 细胞培养 环境不像它们在体内的天然对应物,因此 对细胞行为产生不利影响。3D 细胞培养 , 如细胞球体或类器官已经允许一种更加 仿生的方法来进行细胞培养。[6-8]已经广 泛报道,仿生3D 球体培养的细胞在用于 组织工程时优于2D 培养的细胞[9-13] ,并且可以促进更可靠的药物靶标发现,并 使得具有改进功能的宏观组织构建体的工 程。例如,载有干细胞球体的生物墨水的 3D 打印改善了生物制品构建体的功能行 为(例如,成软骨分化和软骨基质沉积) 。 虽然有希望,但是诸如球体培养等3D 培 养技术的生产方法阻碍了它们的临床翻译 , 这些生产方法通常是批处理过程,拥有 属性较低。
这些批量生产技术如微孔[9,10,12,21-24]和悬挂滴[13,2 5-27]需要多个复杂和耗时的步骤,只能提供有限的球体产量 。尽管特定的生物反应器方法可以提高产量,但它们仍然局 限于批处理过程,与微电池和悬挂液滴等隔离技术相比,这 些批处理过程通常对球体直径的控制水平较低。 [28]虽然这 可能足以进行小型实验室规模的实验,但仍然需要具有高生 产率和高单分散性的强大的单步生物制造技术来促进临床尺 寸组织的球体技术的临床翻译。 [29,30]微流体防火分区最近被研究用于将球体生产从批量生产过 程发展为连续生产过程。在中空生物材料隔室中的细胞微流 体封装允许细胞球形成微生物反应器的控制连续生产,这提 供了比传统的批处理工艺更高的生产率。 [31-3提供了比传统 的批处理工艺更高的生产率。 [31-39]
然而, 由于各种原因,传统的片上微流控液滴发生器的设计阻 碍了微流控液滴产生的球体在临床上的广泛应用。首先,传统 的芯片上微流体需要使用不可混溶的液体来形成液滴,这通常 需要使用已知具有潜在危害并且常常与临床应用不相容的油和 表面活性剂。因此,产生的球体形成隔室需要大量清洗, 以试 图在培养/使用之前除去油和表面活性剂,这与耗时的手工过 程有关,这对细胞活力有不利影响。[45,46]其次,虽然传统的 芯片上微流体允许连续的球体生产,但液滴形成通常仅限于滴 水状态,导致低吞吐量(< 10μLmin-1) ,这对于大多数临床应 用仍然不足。最后,从它们的隔室中回收球体以进行进一步的 生物制造加工通常需要一个复杂的多步骤过程,这可能对细胞 存活产生不利影响。因此,仍然需要一种清洁、快速、细胞友 好和单步生物制造策略,使大型工程组织具有原位球化形成特 性。
在这里,我们介绍了一种新的空气微流体(IAMF)[48]为基 础的生物打印技术,克服了球体使用的翻译限制。具体来说, IAMF 实现了包含无生物材料细胞的隔室的生物物质工程,这 些隔室起到了球体形成微反应器的作用。有利的是,这种创新 方法代表了用于以临床相关速率(1-8.5 mL min-1相当于10000 个球体 s-1)产生高密度细胞球体的临床尺寸水凝胶的工程的单 步生物制造技术。生产能力的显著提高是由于 IAMF 能够单分 散地赋予喷墨生物印刷油墨在喷射状态下具有中空隔室,而传 统的芯片上方法仅限于更慢的滴水状态。这种新型的生物制造 过程也是非常清洁的,因为 IAMF 消除了传统上对油,表面活 性剂或牺牲模板的需要, 以在工程组织内创建空心隔室。除了 传统的基于机器的喷墨生物打印之外,我们证明我们的内联自 下而上的生物制造也可以以简单的手持设备的形式使用, 以手 动打印具有多种复杂性的球体形成的分隔水凝胶,这进一步促 进了该技术与临床应用的兼容性。虽然微型组织的大规模生产 的翻译挑战对于过多的不同组织类型是重要的[28] ,但我们 产生了临床大小的软骨组织作为模型组织,同时承认使用这种 方法也可以产生广泛的其他(器官)形状。
2.1. 空气微流体技术在分区水凝胶生物制备中的应用
IAMF 是一种微流体方法,通过在空气中将液体射流与由压电 驱动的液体射流产生的恒定周期的水滴流碰撞,使得能够以超 高吞吐量产生无芯片、无油和细胞相容的单分散微粒。 [48]
在这项研究中,我们将 IAMF 与喷墨生物打印相结合, 以允 许空气中形成的中空微胶囊的控制合并,从而能够生产大规模 的区室化水凝胶。为此,将两个微喷嘴设置与可移动的 XYZ收集工作台结合使用(图1a)。
为了形成中空微胶囊,含有氯化钙(CaCl 2)的核心微喷溶液 与通过使用压电驱动将振动叠加到微喷嘴上而产生的受控液滴 系统相撞(图1b)。具有降低表面张力(jcore > jalgate)的海藻酸 盐前体微喷的 Dropjet 聚结允许 Marangoni 驱动的封装(图1c) 。这种封装过程发生在 je something (iμD4/阝j2)1/3的时间尺 度上,i,D ,μ 和 j 分别表示微喷密度,直径,粘度和表面张 力,通常在几毫秒内。这使得在收集液滴之前的10-100毫秒的 液滴飞行时间内可以完全封装。这使得能够生产含有 CaCl2 核 心和海藻酸盐前体外壳的双层液滴。由此产生的核壳(即海藻 酸钙)化合物液滴通过从核心层向海藻酸盐层扩散的 CaCl2 以内 向外的方式交联(图1d)。由于离子海藻酸盐交联发生在毫秒范 围内[50] ,并且由于交联的内向外性质,当复合液滴仍然在空 气中时, 内部海藻酸盐层交联,而外部海藻酸盐层通过 Ca2 + 离子的内向扩散随时间发生交联。然后通过可移动的XYZ 收集器或微喷台以控制的方式收集部分交联的微胶囊。
值得注意的是,撞击的时刻是定时的,使得空气形成的微 囊的交联仍然在进行中,使得它们在着陆时立即与微囊进行物 理接触,从而有效地形成包含空心微隔室的瞬时固体3D 构建 体(图1e)。
我们假设通过使用标准的基于液滴的生物制造方法调整微 胶囊放置,可以以强大的,可预测的和可控的方式形成1D 纤 维,2D 平面和3D 体积的分区水凝胶(图1f)。使用手持生物打 印装置(图1g,h)证明了这种生物制造方法,其允许使用形状 稳定的区室化水凝胶手动直接填充缺陷(图1i-k)。该手持方法 预计将促进临床应用,如在外科手术过程中的原位生物打印。 此外,我们证明了这种新型的生物制造方法也可以与可编程3D生物打印机(图11,m)相结合,我们证明了允许生产由更复杂 的几何形状组成的大规模结构,如形状稳定的管状分区水凝胶 (图1n,o 和电影 S1,支持信息)。IAMF 的超高通量性质(高 达8.5 mL min-1)(图 S1,支持信息)允许以快速,直接和单步 方式生物制造临床尺寸的分区水凝胶(图1p,q)。
由于 IAMF 产生的液滴的超高吞吐量和短的空中飞行时间,通 常需要快速(毫秒)交联策略,如所提出的海藻酸盐离子交联或 光聚合。然而,依赖于较慢(几秒钟)交联机制的材料,如丝素 蛋白,仍然可以利用海藻酸钠作为牺牲结构互穿网络模板。
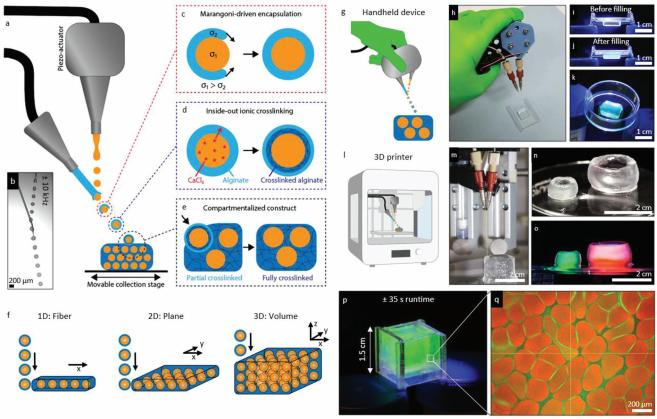
图 1. 高度分隔水凝胶的空气微流体生物制造。 ,a )使用空气微流体方法中的两个喷嘴的分区水凝胶生产过程的示意图。 ,b) 空气中液滴形成 和液滴/隔室封装的显微照片。 ,c) 表面张力马兰戈尼流能够通过水凝胶前体溶液封装核心液滴。 ,d) CaCl2从两层全水液滴内部向藻酸盐层扩 散,实现由内而外的离子交联机制,导致在两个液滴层之间的界面处交联藻酸盐,而壳中的交联仍然存在,正在进行中。 ,e) 利用微室外壳在受 到冲击时的持续交联来设计固体多室水凝胶。 ,f) 隔室的受控沉积允许 1D 纤维、2D 平面和 3D 体积的隔室水凝胶。 ,g) 示意图和 h) 具有集 成空气微流体装置的 3D 打印机的照片。 ,i) 使用 3D 打印机打印的空心管状分隔水凝胶结构的照片,j) 通过包含葡聚糖-FITC(绿色)和葡聚 糖-TRITC(红色)染色溶液观察到不渗漏。 ,k) 用于对隔室水凝胶生物墨水进行手动喷墨生物打印的手持式IAMF设备示意图。 ,l) 用于直接填 充塑料模具缺陷的手持式 IAMF 设备的照片。,通过手持式喷墨生物打印,模具 m) 之前和 n) 之后的荧光照片,o) 被证明形状稳定,即使从模具中取出后,也被证明形状稳定。 ,p) 以 8.5 mL min-1 的生产率生产的隔室荧光水凝胶的照片,能够在 35 秒内填充1.5× 1.5× 1.5 cmmmold 。 ,q)共焦荧光显微镜证实了隔室化水凝胶的形成,其中藻酸盐用葡聚糖-FITC染成绿色, 中空核心用葡聚糖-TRITC染成红色。
2.2. 使用空气微流体生物制造对微室和大凝胶的尺寸、形 状和各向同性控制
藻酸盐水凝胶的尺寸和形状以及它们所包含的中空隔室是 根据不同尺寸的微喷嘴在可移动的 XYZ 平台上的放置来控制 的。内径为 50 、100 、150 和 200 μm 的微喷嘴产生的单分散 (CV < 10%) 隔室尺寸分别为 140 ± 5 、219 ± 14 、277 ±12 和 347 ± 18 μm(图 2a 、b) ,这代表着对传统高通量技术 (例如通常与组织尺寸的多分散性相关的大型生物反应器)的 显着改进。 [28]
具有不同尺寸的隔室水凝胶,如 1D 纤维、2D 片材和 3D 体积,可以通过微喷嘴在多个维度上的移动来实现,其理论 分辨率类似于隔室尺寸(140 ± 5、219 ± 14、277 ± 12和 347 ± 18) ,μm(对于内径分别为 50、100、150 和 200 μm 的核心喷射微喷嘴)。产生这些基本形状的能力为 通过进一步组装这些形状来制造更大的任意形状的组织提供了 机会。 [53],隔室纤维是通过微喷嘴在单一维度上的移动产生 的(图2c ,d)。独特的是,这创建了包含椭圆体隔室的水凝 胶纤维,其伸长率为 1.7 +/- 0.5(图 2e),其椭圆体形状 始终遵循纤维的方向(图 2f)。,这种隔室形状控制提供了有 趣的可能性,因为众所周知,在培养/生长微组织的物理空间 中赋予伸长率会导致一致且独特的行为,从而指导其他形态发 生。 [54]

图2。在空气微流控生物制造中产生的一维、二维和三维区域化水凝胶中受控而独特的形态。A)使用具有不同直径的各种喷嘴制备的中空海藻酸盐微胶囊的显微照片,其有效地控制具有高单分散性(n = 150)的水凝胶隔室的直径 b) 。C)一维分隔光纤的亮场显微照片。D)用葡聚糖 -FITC 染绿的海藻酸钠区室化纤维和用葡聚糖 -TRITC 染红的区室的荧光共聚焦显微照片。E)与其分隔的纤维(n = 54)相比,隔室对齐的定量。F)一维 纤维中隔室的椭球延伸率与其隔室化水凝胶的三维体积相比(n = 54) 。G)用于书写和织造多室有效载荷(绿色葡聚糖 -FITC 和红色葡聚糖 -TRITC )的区室化纤维的荧光共聚焦显微照片。H)二维分区水凝胶片的亮场显微照片。I)使用葡聚糖 -FITC 和使用 DextranTRITC 染色的红色隔室的海 藻酸盐染色的区室化片的荧光共聚焦 z 堆栈。J)单个切片(左)沿 xy 平面(顶部)和 x 平面(底部)划分的平面的荧光强度直方图, 以及作为构建体 (右)的平均值。K)荧光共聚焦三维重建海藻酸盐染色的单层分隔板.。
此外,如使用葡聚糖 -TRITC (四甲基罗丹明异硫氰酸盐) 和葡聚糖 -FITC (异硫氰酸荧光素,图2g)所示,通过利用2D 中的可移动微喷嘴级,使用微隔室中的各种有效载荷可以用这 种生物制造技术形成多种材料写作。此外,形成的纤维具有良 好的可操作性(例如,易于手工操作) ,这可能用于诸如编织 (图2g) ,编织和编织等应用,而不会不可避免地出现纤维故 障。 [55-58]据报道,对齐载细胞纤维的能力能够改善组织工 程应用,其中对齐是重要的,如肌肉组织工程应用。此外,载 细胞的微纤维也被用于胰岛细胞包封,利用植入患者体内时纤 维的易回收性。 [55,62]
在一个维度上移动微喷嘴产生水凝胶微纤维,二维运动允 许形成空间组织的单层水凝胶片(图2h)。共聚焦 z 叠加分析 证实了印刷水凝胶片内隔室的中空(例如,水性和非交联)性质 (图2i)。值得注意的是,形成的水凝胶拥有属性具有对称性和 各向异性的特性,这一点通过单个共焦切片的半定量直方图分 析得到了证实(图2j)。X 或 Y 平面的平均直方图数据显示隔 室的随机放置,而 Z 平面显示在特定高度的隔室放置方面是 一致的。诸如多层和多种材料的平面中的复杂性可以通过重复 平面形成的受控过程来增加,这导致由多层平面组成的水凝胶 , 其提供了以高度定义的方式使用多种材料或材料性质的潜力 (图2k,l)。二维载细胞片可以作为补丁起作用, 已经证明其 在心脏组织工程应用和伤口愈合补丁等方面是成功的[63-65] , 并且可以卷起来模拟管状结构。 [66]
空气印刷的退火微胶囊也被证明是容易地能够迅速地产生 大量的3D 分区水凝胶(图2m,n)。含有球体的3D 水凝胶已被 证明与广泛的生物医学应用相关,例如,它一直被证明可以增 加软骨形成和软骨形成。 [10,12]虽然放置在二维分隔板中的 隔室具有可重复的各向异性,但三维体积的平均构造直方图显 示三维体积是各向同性隔室放置的拥有属性(图2o,p)。填料 密度(隔室/容积)可以通过调整隔室尺寸来控制,方法是使用 不同内径的芯射流微喷嘴以及通过相对流量来控制。在与新喷 射舱碰撞时,没有观察到装配结构的动力位移。
与传统的0D 水凝胶隔室(如微胶囊)相比,1D ,2D 和3D 材 料的隔室化水凝胶的空气中微流体生物制造提供了更高的可操 作性。具体而言,水凝胶微胶囊通常悬浮在液体中,因此必须 通过例如移液技术来处理, 由于粘附在培养塑料或移液管尖端 上,导致微粒容易丢失或物理损伤。相比之下,这里描述的
1D 纤维,2D 片材和3D 体积等较大的结构可以使用铲子和/ 或镊子等工具在宏观层面上进行处理,这些工具允许简单的复 杂操作,如书写,编织或堆积单独的材料,从而最大限度地减 少损失或损害。
2.3. 细胞负载的分隔水凝胶内软骨形成球体的超高通量生产
使用IAMF,可以以比传统微流体高850倍以上的吞吐量生产 大型分隔水凝胶(传统微流体为10 μLmin-1 [31],而IAMF分 隔水凝胶为8.5 mL min-1 )。这种方法可以用于以前所未有的 速度(10 000 个球体 s-1 )大规模生产细胞球体。
为了证明这一点,C20A4软骨细胞通过将细胞引入核心微射 流溶液(图3a)被包裹在区室化的水凝胶中。在细胞负载的区室 化水凝胶形成后,立即用多余的培养基洗涤水凝胶,随后提供 新鲜培养基。在24小时内在水凝胶隔室内形成的细胞球体能够 在3D 水凝胶(图3b)和1D 纤维(图 S2,支持信息)内在隔室内 培养至少21天,其在至少21天的培养中保持稳定。与喷嘴对照 相比,喷射时细胞活力保持高(95.6 ± 2.8% 比95.6 ± 0.5) (图3c,d) ,这是可以预期的,因为潜在的有害剪切力主要由 液体的粘度决定,在本研究中是非常低的。细胞活力在随后的 细胞培养中保持高水平(96 ± 3%)(图3c,d)包封的细胞的数量通过调节核心微喷溶液中的细胞浓度来 控制,在核心微喷溶液中分别为每隔室13 ± 5,38 ± 10和73± 15个细胞,分别为2 × 106,5 × 106和107个细胞 mL-1 (图S3,支持信息)。形成的细胞球体具有单分散的尺寸分布(第1 天 CV ≤10%) ,这表明在 IAMF 产生的区室化水凝胶内控制 细胞球体的形成(图3e,f)。
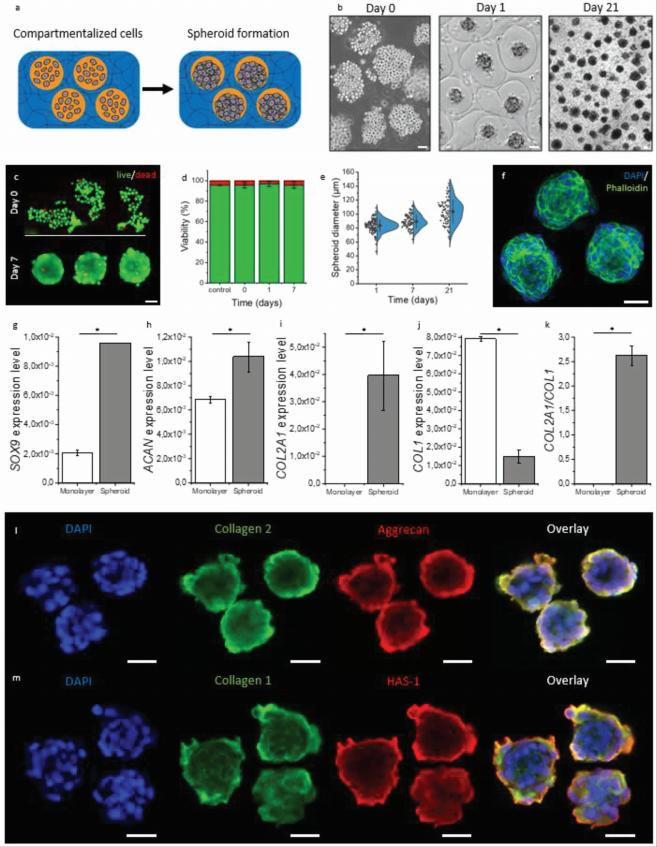 图3。在空气中生物打印区室化水凝胶中原位形成球体。A)区室化水凝胶内球体形成示意图。B)第0天,第1天和第21天包裹的软骨细胞的亮场显 微照片。C)在第0天(顶部)和第7天(底部)用活细胞染色的活力染色的荧光显微照片使用钙黄绿素 -AM 染色绿色,使用同型二聚体乙锭染色红色 的死细胞。D)在区室化水凝胶(n = 136个球体)中培养0,1和7天后活的软骨细胞部分的定量。E)在间隔化水凝胶(n = 100)中培养21天以上的球体 直径的定量。F)使用4’,6-二脒基 -2-苯基吲哚(DAPI)和使用 Alexa Fluor 488鬼笔环肽在分隔的水凝胶中培养21天后使用 F- 肌动蛋白染色的蓝色 核球体的共聚焦荧光显微照片。G)软骨形成标志物 g) SOX9 ,h) ACAN 和 i) COL2A1和纤维软骨标志物 j) COL1的相对 mRNA 水平, 以及COL2A1和 COL1之间的 k)相对比率作为来自人原代软骨细胞的软骨表型的指示培养为单层或球体在区室化水凝胶中21天(每个 n = 2,50000个球 体)。使用) dAPI (蓝色) ,胶原蛋白2(绿色) ,聚集蛋白聚糖(红色)和 m) dAPI (蓝色) ,胶原蛋白1(绿色)和透明质酸合酶1(HAS1)(红色)的免疫 荧光染色在软骨培养基中培养21天后可视化在分隔的水凝胶中形成的细胞球体的荧光显微照片。比例尺等于50微米。数据以平均值 ± SD 表示 。P < 0.05的显著性由 * 表示。
图3。在空气中生物打印区室化水凝胶中原位形成球体。A)区室化水凝胶内球体形成示意图。B)第0天,第1天和第21天包裹的软骨细胞的亮场显 微照片。C)在第0天(顶部)和第7天(底部)用活细胞染色的活力染色的荧光显微照片使用钙黄绿素 -AM 染色绿色,使用同型二聚体乙锭染色红色 的死细胞。D)在区室化水凝胶(n = 136个球体)中培养0,1和7天后活的软骨细胞部分的定量。E)在间隔化水凝胶(n = 100)中培养21天以上的球体 直径的定量。F)使用4’,6-二脒基 -2-苯基吲哚(DAPI)和使用 Alexa Fluor 488鬼笔环肽在分隔的水凝胶中培养21天后使用 F- 肌动蛋白染色的蓝色 核球体的共聚焦荧光显微照片。G)软骨形成标志物 g) SOX9 ,h) ACAN 和 i) COL2A1和纤维软骨标志物 j) COL1的相对 mRNA 水平, 以及COL2A1和 COL1之间的 k)相对比率作为来自人原代软骨细胞的软骨表型的指示培养为单层或球体在区室化水凝胶中21天(每个 n = 2,50000个球 体)。使用) dAPI (蓝色) ,胶原蛋白2(绿色) ,聚集蛋白聚糖(红色)和 m) dAPI (蓝色) ,胶原蛋白1(绿色)和透明质酸合酶1(HAS1)(红色)的免疫 荧光染色在软骨培养基中培养21天后可视化在分隔的水凝胶中形成的细胞球体的荧光显微照片。比例尺等于50微米。数据以平均值 ± SD 表示 。P < 0.05的显著性由 * 表示。
使用葡聚糖 -FITC 和使用葡聚糖 -TRITC 染红的隔室。L)荧光共聚焦3D 重建具有多室有效载荷(绿色葡聚糖 -FITC 和红色葡聚糖 -TRITC)的双层 区室化平面。M)三维分区水凝胶体积的亮场显微照片。N)使用葡聚糖 -FITC 和使用葡聚糖 -TRITC 染色的红色隔室的区室化体积与海藻酸盐染 色绿色的荧光共聚焦 z 堆栈。O)单个切片(左)沿 xy 平面(顶部)和 x 平面(底部)分隔体积的荧光强度直方图,并作为构建体(右)的平均值。P)使 用葡聚糖 -FITC 和使用葡聚糖 -TRITC 染色的红色隔室,用海藻酸盐染色的单层区室化水凝胶体积的荧光共聚焦3D 重建。比例尺等于500微米 。数据以平均值 ± SD 表示。
控制被包裹细胞数量的能力以及由此形成的球体直径尤其 重要,因为球体直径已知会影响生物学功能。 [12]以前的研究 报道,与单个细胞和较大的球体相比,通过增加 SOX9,ACAN 和 COL2A1的表达,同时降低 COL1的表达,每个球体产生50-1 00个细胞,从而改善成软骨性能。因此, 以107个细胞 mL-1包 裹原代人软骨细胞进行软骨形成实验,其相当于每个隔室73± 15个细胞。
原代人软骨细胞在分区水凝胶中形成球体或在成软骨培养 基中作为单层培养21天。与单层相比,区室化水凝胶中的软骨 细胞表达显着更高水平的软骨形成母转录因子 SOX9(图3g)以 及关键软骨细胞外间质组分 ACAN (图3h)和 COL2A1(图3i) , 同时表达较低水平的不需要的纤维软骨标志物 COL1(图3j)和 较高的 COL2A1/COL1比率在细胞球体中与单层培养物相比(图 3k)。结合起来,基因表达谱证实了在中空区室化水凝胶内自 主形成的细胞微球确实与比单独分散在整个固体水凝胶中的细 胞更强的成软骨表型相关联。为了确认在区室化水凝胶中球体 是否发生了真正的成软骨行为,对暴露于成软骨分化培养基21 天的球体进行了免疫荧光染色。事实上,区室化水凝胶中的球 体表达软骨标志物,如胶原蛋白1,胶原蛋白2,聚集蛋白聚糖 和透明质酸合成酶1(图31,m)。这些结果表明,在区室化的水 凝胶中自主形成的球体,在类似于传统的低通量产生的球体的 软骨形成性能方面优于传统的单层培养物[9] ,现在可以考虑 用于软骨工程,特别是作为一种新的方法, 以清洁,细胞相容 , 单步和临床可伸缩的方式实现细胞球体的益处的临床翻译。
2.4. 在空气中微流控球形成区室化水凝胶允许形状稳定的临 床尺寸的无生物材料细胞组织的形成组织形成。然而,球体培养也被发现有利于工程无生物材 料的活组织的形式自下而上的组织工程利用球体作为模块化的 建设模块。与传统的单细胞技术相比,细胞球体允许生产更多 的形状稳定的组织。这种严格的形状和体积控制在可预测的组 织工程和适形缺损填充中非常重要,因为结构收缩的开始将不 可避免地导致不想要的缺陷和空洞的形成。不幸的是, 由于现 有的球体批量生产过程,这些临床尺寸的构建体仍然无法达到 , 因为需要大量的球体来形成大规模的组织构建体 ; 传统的球 体生产过程只提供低生产率。为了解决这个问题,我们假设区 室化的水凝胶可以被牺牲,因此作为临时和可自由选择的3D微反应器来促进单分散细胞球体的大规模生产。实际上,扩展 到第三维度将显著提高球体生产率,因为金标准生产平台的本 质都是二维的。我们推断,区室化水凝胶的超高通量球体生产 性质将能够生产形状稳定,临床大小的无生物材料的细胞组织 (图4a)。
为了产生只有315 μL 体积的完整细胞组织所需的球体数量 , 这估计常见的全厚度软骨缺陷为1.5 cm2 [68] ,将需要总共 150个12孔板的单个孔(每孔3600个球体[9])(图4b)。因此,训 练有素的手工劳动的数量被认为是不可扩展的,因此挑战广泛 的临床翻译球体为基础的细胞组织。然而,利用连续的 IAMF 分区水凝胶方法,只需要60秒的运行时间就可以产生相同数量 的球体(图4b)。值得注意的是,特定的医疗应用需要更大的组 织尺寸才能被认为是临床尺寸,这可以通过将生产运行时间从 一分钟延长到几分钟来轻松实现。预计将多个连续的工匠批处 理过程演变为单个连续的亚分钟运行时过程, 以促进使用细胞 球体构建块自底向上工程大型组织的可行性。此外,我们的新 方法也更加生态友好,因为它大大减少了塑料板需要创建这种 自下而上的方法大型活组织的数量。软骨细胞球体在海藻酸钠隔离的水凝胶中大量生产,并培 养4天后使用海藻酸钠裂解酶洗涤步骤酶促回收(图4c)。
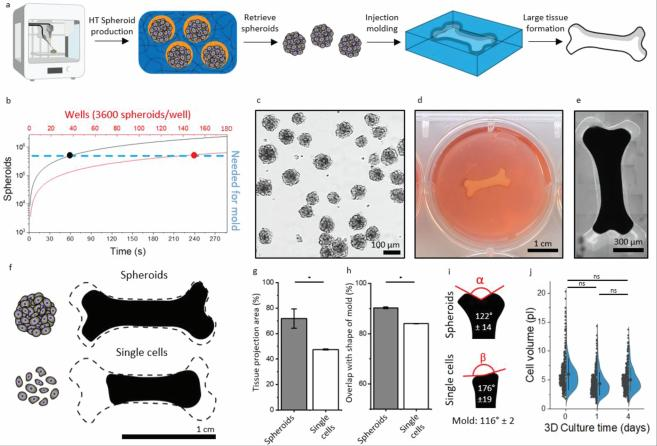
图4。分区水凝胶作为临床尺寸细胞组织工程球体生产的3D 平台。A)临床大小的细胞组织形成示意图,包括在区室化水凝胶中的高通量(HT)球 体生产,从区室化水凝胶中检索球体,琼脂糖模型中的球体注射制模, 以及随后的组织形成。B)需要与空气微流体运行时相比的微孔的理论表示需要创建 ± 540000个球体,这是填充模型注射模具所需的。C)海藻酸裂解酶处理后回收的软骨细胞球体的亮场显微照片。D)在培养24小时后 , 在12孔板中的琼脂糖霉菌中形成的厘米大小的组织的照片。E)培养24小时后形成的组织的缝合显微照片。F)在原始模具形状轮廓的顶部,用 球体(顶部)或单个细胞(底部)投影形成的组织。G)由球体或单个细胞形成的组织的组织投影面积相对于霉菌的投影面积(n = 4) 。H)已形成的组 织与球体或单个细胞相对于霉菌形状的重叠(针对组织投影区域校正)(n = 4) 。I)由球体(顶部)或单个细胞(底部)产生的已形成组织的投影, 以红 色表示角度, 以白色表示测量角度(n = 4) 。J)培养后软骨细胞的细胞体积和在分区水凝胶内形成的球体在0(对照) ,1和4天的培养(n = 500)。数据以平均值 ± SD 表示。P < 0.05的显著性由 * 表示。
由于海藻酸裂解酶的生物相容性和正交性[69]以及温和的洗涤 过程,没有观察到球体形态的变化。值得注意的是,这种细胞 球体的检索方法与其他常用的球体形成平台(例如从微孔中回 收的球体的强力流体动力学搅动)相比,提供了明显更温和的 条件的优势。将大约540000个球体或等量(4 × 107)的单个细胞 注射到厘米大小的骨形模具中以形成厘米大小的工程组织。选 择骨的符号形状是因为它适合于评估形成的组织的形状稳定性 (图4d ,e)。我们观察到,与单个细胞相比,利用球状注射制 模进行大规模组织切割可以获得更好的形状稳定性(图4f)。具 体而言,如组织投射面积所示,大规模生产的球体与较低的组 织收缩相关,在单天培养后,球体为71.7 ± 7.3% ,单个细胞 为47.5 ± 0.4% (图4g)。
此外,当接种球体(90.3 ± 0.2%)时,生产的组织与注射模具的 形状显示出更高的重叠,而当使用单细胞(84.0 ± 0.1%)时(图 4h)。这一观察结果得到了完全细胞状骨组织物理末端角度的 测量结果的证实。球体的骨形组织(122 ± 14 。)的曲线保持与 所用注射模具(116 ± 2 。)的高保真度,而使用单细胞悬浮液(176 ± 19 。)时角度几乎丧失(图4i)。我们推断,在三维微组织 形成过程中发生的凝聚阶段的细胞收缩可能为观察到的工程化 大细胞组织形状稳定性的差异提供了解释。细胞体积分析显示 , 将来自2D 环境的细胞置于3D 环境中导致单日培养后细胞 体积从6.0 ± 2.7降至4.4 ± 2.3 pL (图4j)。此外,细胞体积在进 一步的3D 培养过程中保持稳定(5.0 ± 2.1 pL)。这表明,区室 化水凝胶中最初的球体形成创造了微组织构件,这些构件与来自2D 培养物的单个细胞不同,在用于工程大细胞组织时不会 收缩,因此在用于活组织的注射模具工程时提供了更好的形状 稳定性。
IAMF 允许成功生产细胞负载的空心分区水凝胶,使原位 形成细胞球体在超高通量,清洁,单一步骤的方式。这种创新 技术被证明与传统的喷墨生物打印技术兼容,这种技术促进了 具有多种复杂性的分区水凝胶的生产,而手持喷墨生物打印允 许快速和容易的分区球体形成水凝胶的自由生物制造。利用IAMF 的超高通量,在相关的时间框架内实现了基于球体的临 床尺寸软骨组织的可扩展生产,这代表了细胞球体临床翻译的 重要一步。
IAMF 设置: 用于区室化水凝胶的 IAMF 设置由两个相似喷 嘴直径的锥形喷嘴(Idex Health & Science)组成,定位角度 为 ± 40 ° , 使用微米精度 XYZ 级(Thorlab)对准。喷嘴连 接到鲁尔锁定玻璃注射器(汉密尔顿)与氟化乙烯丙烯(FEP)管 (ID250 μm,杜邦公司)。流量由低压注射泵(neMESYS,Cetoni )控制。主喷嘴连接到一个压电驱动器,该驱动器以5Vpp 的频 率工作,频率在1至10kHz 之间,这取决于所使用的喷嘴直径 , 从而可以控制微喷的破碎。二次喷嘴的排列使其微射流与一 次微射流的单分散液滴序列相结合。使用高速显微镜照相机(SMZ800N,附有 uEye usb 照相机的尼康,IDS)证实了微喷与 液滴列车的受控液滴破碎和合并。
海藻酸钠分区水凝胶的制备和分析: 主要微喷由10% w/v葡聚糖(40kDa,Pharmosmos)和50 × 10-3m 氯化钙(CaCl 2) (Sigma-Aldrich)组成。在 dH2O 中,二次微喷由0.5% w/v 海 藻酸钠(80-120cP,FUJIFILM Wako)和10% v/v 乙醇(EtOH)组 成。使用不同的喷嘴直径(50,100,150和200μm)来制造不同舱 室尺寸的舱室。对于直径为50 μm 的喷嘴,驱动器频率为6.5 kHz 的一次和二次微喷分别采用0.9和1.1 mL min-1的流量。
对于100 μm 直径的喷嘴,分别使用2和2.2 mL min-1的流量对 于具有5.5 kHz 的驱动器频率的一次和二次微喷射,或者分别 使用4和4.5 mL min-1的流量对于一次和二次微喷射,如果表 明总流量为8.5 mL min-1,驱动器频率为5.5 kHz。对于直径 为150 μm 的喷嘴,驱动器频率为4.5 kHz 的一次和二次微喷 分别采用3和3.2 mL min-1的流量。对于直径为200 μm 的喷嘴 , 驱动器频率为3.5 kHz 的一次和二次微喷分别采用4和4.2mL min-1的流量。微射流的拥有属性为 We ± 25,碰撞角度 为 ± 40 ° , 相当于 We Impact ± 10。
使用多种制备方法生产分区水凝胶。对于第一种选择,将喷嘴固 定在位置上,并将空气形成的隔室收集在可移动 XZ 收集台上的培养皿中,用于生产隔离的水凝胶。对于第二种选择,将喷嘴固定在3D 打 印机(Inkredible + ,CELLINK) 的可移动打印头(1m s-1)上,并将空气形成 的隔室收集在培养皿中以生产隔离的水凝胶。对于第三种选择,将喷 嘴固定在手持设备上,允许手动沉积空气形成的隔室,用于生产隔离 的水凝胶。无论使用哪种装置,都可以通过控制喷嘴或收集培养皿的 运动来生产一维纤维、二维平面和三维体积的分隔水凝胶。
使用明场显微镜(EVOS FL 成像系统,ThermoFisher)观察划分的水凝 胶。间隔直径用 Feret 直径测量。通过将0.5 mg mL-12000 kDa 葡聚糖 – TRITC (Sigma-Aldrich)添加到一次微喷中和0.5 mg mL-12000 kDa 葡聚糖 – FITC (Sigma-Aldrich)添加到含有二次微喷的海藻酸盐中来研究隔室的中 空性质。荧光标记的区室化水凝胶分析使用共聚焦 z 叠加显微镜分析 (尼康 A1共聚焦)。利用 ImageJ 软件对粒度分布、单分散性、角度取向 、椭球伸长率和荧光强度进行了分析。
细胞培养: 将 C20A4软骨细胞(人软骨细胞系,Sigma Aldrich,SCC041)在含有10% 胎牛血清(FBS ,SigmaAldrich) ,100U mL-1青霉素 (Gibco)和100μgmL-1链霉素(Gibco)的 Dulbecco 改良的 Eagle 培养基(DMEM ,Gibco)中培养。培养基每两周更换一次。将人软骨细胞在含 有 DMEM ,10% FBS ,100U mL-1青霉素,100μgmL-1链霉素,0.1 × 10- 3mL 脯氨酸(SigmaAldrich)的增殖培养基中培养,1% 非必需氨基酸(NEAA , Sigma-Aldrich)和1% 抗坏血酸(ASAP ,Sigma-Aldrich)或在含有 DMEM , 100U mL-1青霉素,100μg mL-1链霉素的软骨培养基中,0.1 × 10-3mL- 脯氨酸(Sigma-Aldrich) ,1% 非必需氨基酸(NEAA ,SigmaAldrich)和1% 抗坏血酸(ASAP ,Sigma-Aldrich) ,10ng mL-1TGFb3(R & D 系统)和0.1 × 10-6m 地塞米松(Sigma-Aldrich)。达到80% 融合时,细胞传代。
细胞培养物保存在37 °C,含5% CO2的潮湿环境中。细胞包裹: 当制 备细胞负载的区室化水凝胶时,微射流溶液中的 dH2O 被无磷酸盐(Gibco)的 DMEM 所取代。使用胰岛素乙二胺四乙酸(Invitrogen)分离细 胞,用培养基洗涤,随后通过40μm 细胞过滤器(EASYstrainer ,Greiner )以确保单细胞悬浮。除非另有说明,然后将细胞悬浮于初级微喷溶液 中的107细胞 mL-1。然后将载有细胞的溶液装入并保存在冰冷的气密 注射器中,持续封装过程(< 10分钟)。在细胞封装实验中,喷嘴直径为 100μm ,一次和二次微喷的流量分别为2和2.2 mL min-1,压电致动器 的频率为5.5 kHz。载细胞的区室化水凝胶收集在培养皿中或直接进入 培养板。生产完成后,立即用培养基清洗分隔的水凝胶, 以洗去多余 的乙醇,维持高细胞活力。最后,加入新鲜培养基,将分离的水凝胶 置于培养基中。
通过明场显微镜(EVOS FL 成像系统,ThermoFisher)监测细胞包裹后 的细胞聚集。根据制造商的方案(Invitrogen) ,通过用钙黄绿素 AM 和 乙锭同源二聚体 -1染色研究细胞活力,并使用数字荧光显微镜(EVOS FL image System ,ThermoFisher)进行成像。
对于额外的分析,用磷酸盐缓冲盐水(PBS)洗涤载有细胞的区室化 水凝胶,并使用10% 缓冲福尔马林溶液(Sigma-Aldrich)固定。使用0.1% Triton X-100(Sigma-Aldrich)使细胞透化,随后用2.5 U mL-1鬼笔环肽 -F488(Thermo Fisher Scientific)和10μgmL-1DAPI (Thermo Fisher Scientific )分别染色 F- 肌动蛋白和细胞核。荧光染色的样本分析使用共聚焦显 微镜(尼康共焦 A1)和 ImageJ 软件。
基因表达分析: 将原代人软骨细胞包裹在分区水凝胶中,在成软骨 细胞培养基中培养21天。作为对照,原代人软骨细胞单层培养。用TRIzol (Invitrogen)裂解缓冲液制备用于即时聚合酶链式反应(qPCR)分析 的样本,并按照供应商提供的方案,使用 miRNeasy 试剂盒(QIAGEN)进 行 RNA 分离。使用 iScript cDNA 合成试剂盒(Bio-Rad)合成 cDNA。然后 , 在 CFX Connect 实时系统(BioRad)上使用 SensMix SYBR 和荧光素试剂 盒(Bioline)对 cDNA 进行 qPCR。
软骨生产分析: 将原代人软骨细胞包裹在分区水凝胶中,在成软骨 培养基中培养21天。使用10% 缓冲福尔马林溶液固定球体,使用0.1% Triton-X (Sigma-Aldrich)透化,使用10% 牛血清白蛋白(Sigma-Aldrich)封 闭,并使用1:100抗胶原蛋白1(Novus 生物学)染色,1:100抗胶原2(Abcam ) ,1:100抗聚集蛋白聚糖(Abcam)或1:200抗透明质酸合酶1(Abcam)与1: 250 AF488(Invitrogen)和1:200AF647(Abcam)标记的二抗和1:100 DAPI 作 为计数染色。
大细胞组织形成: 将 C20A4细胞包裹在区室化的水凝胶中并培养四 天,在此基础上通过 PBS 洗涤和10U mL-1海藻酸裂解酶(Sigma-Aldrich) 在37 °C 温育30分钟来回收细胞球体。将大约54万个球体(± 4 × 107个细 胞)注射到琼脂糖骨状霉菌中,形成一个大的细胞组织。以4 × 107单个 细胞为对照,注射入骨霉菌中。可以注射细胞的霉菌总体积为315μL , 如前所述生产。[70]使用前将琼脂糖模型在培养基中温育24小时。
使用宏观摄影(佳能 EOS 6D)和明场显微镜(EVOS FL 成像系统,ThermoFisher)分析形成的大型组织。对培养0,1,4天的球体进行胰蛋白 酶消化,通过亮场成像分析细胞大小/体积。使用ImageJ 软件分析大 的组织表面积、形状和细胞体积。
统计分析: 数据以平均值± SD 表示。每个实验的样本量在图形描述 中报告。通过单因素方差分析确定显著性。用 * 表示 p < 0.05的显着性 。所有统计分析均在 OriginPro2017中进行。
关键词
聚集体,生物制造,细胞包裹,隔离水凝胶,空气中微流体, 微流体,球体

